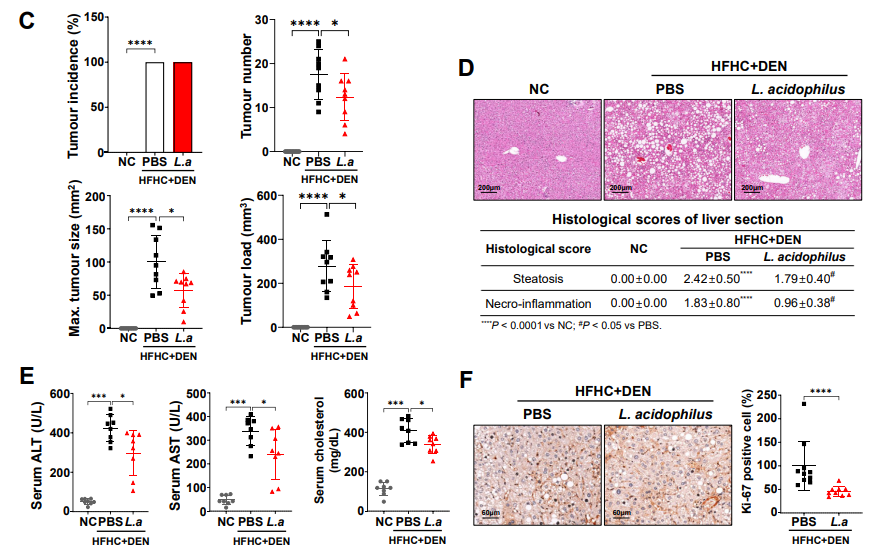
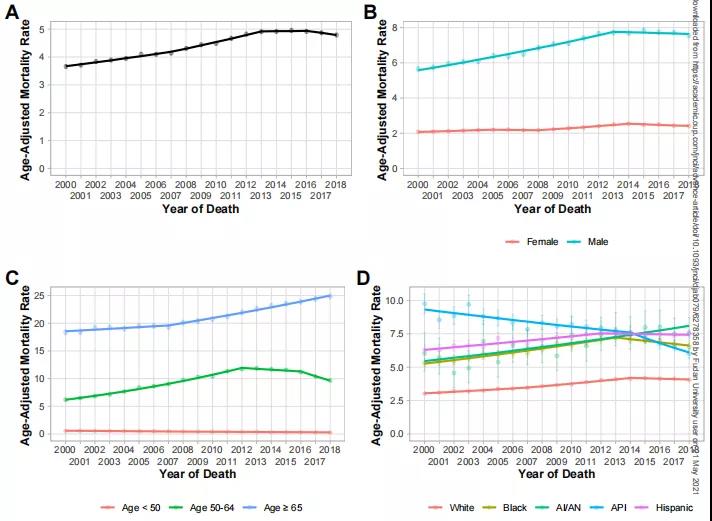
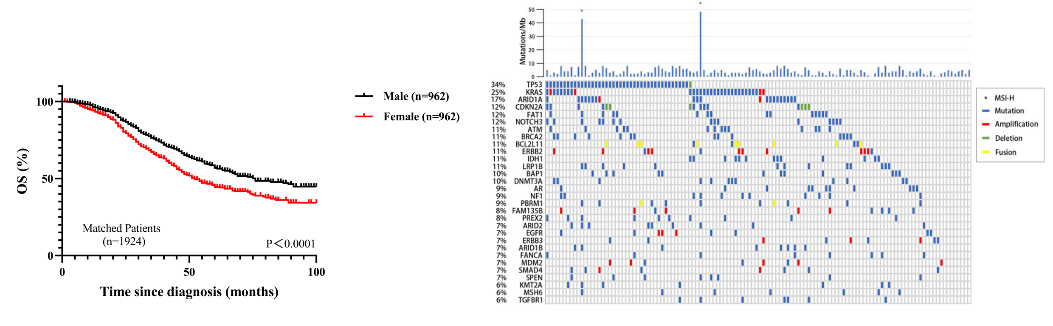
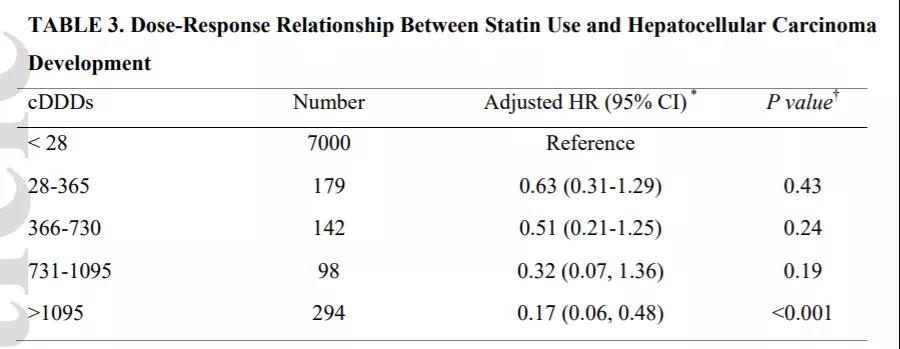
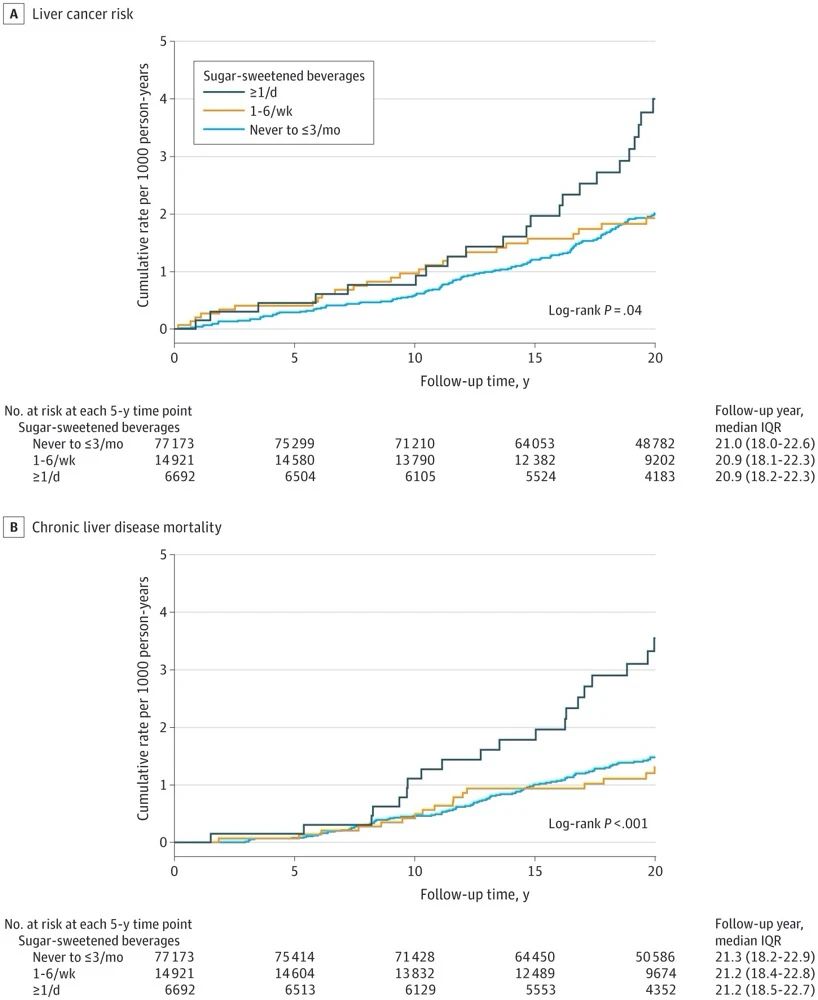
近日,国际顶级肿瘤学期刊《Cancer Discovery》(IF 39.4)在线发表了复旦大学附属中山医院肝癌研究所樊嘉院士团队在肝癌临床研究领域的最新成果,发现老药干扰素α可通过影响糖代谢重塑肝癌免疫微环境,从而克服免疫检查点抑制剂(ICB)的耐药,首次提出将两者联用可改善肝癌治疗效果的新策略。复旦大学附属中山医院樊嘉院士、徐泱副教授及复旦大学朱棣研究员为该文共同通讯作者。复旦大学附属中山医院胡博主治医师、喻敏成博士、马晓路技师、孙嘉磊博士、复旦大学药学院刘成龙博士为该文共同第一作者。 在这项最新研究中,樊嘉院士团队首先基于临床证据发现:在部分晚期肝癌患者中,干扰素α联合PD-1抗体可显著缩小肿瘤体积并对患者肺转移同样具有明显的抑制作用。研究团队进一步构建了小鼠自发性肝癌模型与原位移植瘤模型,与临床发现一致的是,在两种不同类型的小鼠肝癌模型中均显示联合治疗组小鼠肿瘤明显缩小、肺转移减少、生存期显著延长。 研究团队进一步运用流式质谱技术详细地剖析了不同治疗组肿瘤微环境中浸润的各亚群淋巴细胞,发现CD27+CD8+ T细胞这一具有强大的免疫杀伤功能的亚群在联合治疗后的肝癌组织中浸润明显增加,是产生联合抗肿瘤效应的关键亚群。此外,基于公共单细胞数据集的分析证据也同样发现:在免疫治疗有响应的患者中CD27+CD8+ T细胞比例显著升高。团队进一步深入研究了其内在机制,通过转录组测序联合功能实验发现:肝癌细胞与浸润CD8+ T细胞之间的葡萄糖代谢竞争是肝癌发生ICB耐药的全新驱动机制,肝癌细胞可通过竞争性消耗微环境内葡萄糖抑制效应T细胞的活化与杀伤作用。干扰素α正是通过作用于肿瘤细胞一侧,抑制糖酵解关键因子HIF1α的转录活性,有效削弱了肝癌细胞对微环境中葡萄糖的摄取与利用,显著改善微环境失衡状态,从而促进CD27+CD8+ T细胞的浸润。另一方面,CD27+CD8+ T细胞亚群尽管展现了出色的免疫效应功能,但也有一“致命弱点”:高表达PD-1这一经典免疫“刹车分子”,使其无法在干扰素α单独使用时获得完整扩增,而PD-1抗体则可有效解决这一问题,使得干扰素α与PD-1抗体两者形成完美默契,在临床队列与模式动物中均展现出优异的抗肿瘤效果。 干扰素α在临床已有数十年的使用历史,在病毒防治、免疫调节等领域其应用价值已得到充分肯定。但干扰素α单药抗肿瘤疗效欠佳,如何在特定肿瘤免疫治疗中合理使用干扰素α成为极具临床研究价值的重大科学问题。本研究是干扰素这一老药继被纳入《原发性肝癌诊疗规范》推荐的肝癌辅助治疗用药后,在抗肝癌免疫治疗领域的又一重要应用。该研究成果有望有效解决免疫检查点抑制剂的耐药难题,从而改善肝癌免疫治疗的疗效,为晚期肝癌患者带来显著的生存获益。